�ڹ�ȥ�ļ�����Ѿ������ӵ�������ISO 14644-1���ڽ�ISO����ϵͳ��ǰ����ϵͳ���ı䡣Ȼ�������˾����ʹ�ô�ͳ��100������ʮ�ྻ�ҷ���ϵͳ���������209-E����ŷ�ޣ��̻��ܸ�ͼ�總��1ʹ����һ��ϵͳ���ȼ�A��Dָ��������ȫ������ҵѡ��ʹ���������ϵͳ��������Щϵͳ���ǿɽ��ܵ�Ӧ�á����ǣ�����Ҳ�����ڽ�ϵͳ���ӵ�һ�𣬱��磬ISO 10/100��/ A���������͵���������Ϊ����FDA��ָ����������2004�꣩�����Ҫ���������Ʒ����ʹ�ô����ӵķ���ϵͳҲ��̫������һ�����⡣���ǣ�����㲻�������ӹ���Ʒ��ѡ��ķ���ϵͳ������һ����ܻᵼ����������������209E������������������ļ���д�ġ����ļ��ķ�Χ������Ϊ��“ ���ļ��涨���࣬���ṩ�����ྻ��Ϊ����ָ�����������ӵ�Ũ�Ƚྻ�Һͽྻ��������ࡣ���涨�˺˲�����ྻ�ȵķ�����Ҫ�ƻ������������ྻ�ȡ������ṩ��һ�ַ�����ȷ��������������Ũ�ȣ�U��������“ͬ����Ҫ��������ļ���ȷ�������ƣ����а�����” ����ļ���Ҫ�ྻ�һ�ྻ�����������豸����Ʒ��ʹ�á����� ��С������˿ڣ����ļ�����ּ�ڱ�������������ѧ�����䣬������еĿ����Ŀ����ԡ�û��ͨ�õĹ�ϵ�Ѿ����������еĿ�����Ũ�ȵĺͿ��еĿ����еĿ�����Ũ��֮�䡣���� ��Ҫһ�����Ŀ�����Ӧ������������Ⱦ�ͷ��ϼȶ������ƣ��ر�Ҫ���DZ�Ҫ�����ڼ��Ϳ���������ʽ����Ⱦ��“������Щ���ƣ���Ҫ����������Ĵ�����������֧����Щ����ϵͳ��10/100��/��ʮ��ϵͳ���õķ��������Ҳ�����ᵽһ��“M”��ϵͳ���ࡣ����ļ����������ˣ�ͨ��ISO 14644-1ȡ����ISO 14644-1����ϵͳ ISO 14644-1���ྻ�Һ���ؿ��ƻ���-��1���֣������ྻ���ĵ���֤����ʽ������1999��䲼���ļ��涨�Ŀ����ྻ�ȷ������֤Ҫ���ļ��Ѿ�ȡ���˾ɵ������209-E��100������10��ָ�������ڱ��ļ��ĸ��ַ���ϵͳ�ǻ���������Ǵ����������ļ�����Ҫ���ļ������������Ʊ������ڱ�1�С�
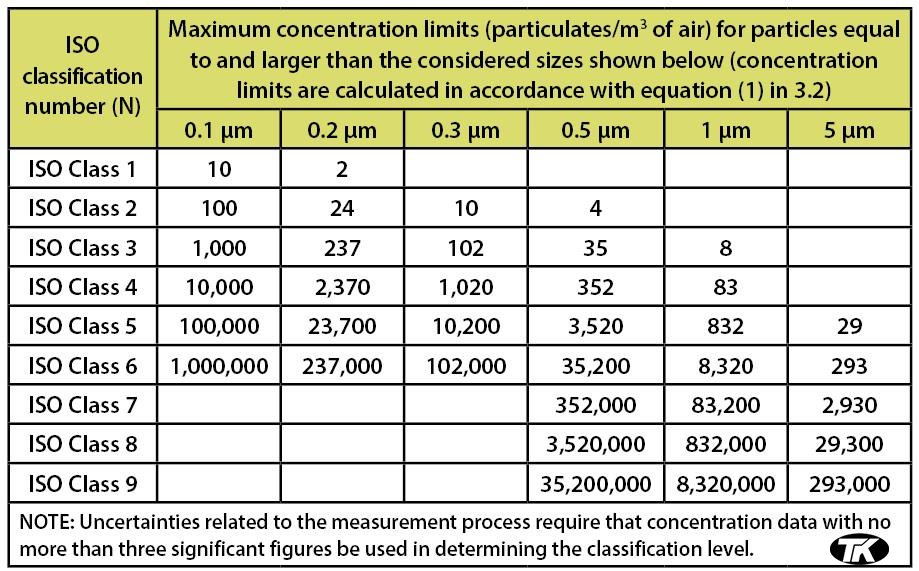
��1��ѡ�������������ȵȼ��Ľྻ�Һͽྻ�����������ISO 14644-1�����ĵ����������������Ʒ�ľ���Ҫ��Ҳ�������κβ����������Ǵ������Ҫ����ˣ���FDA��������ָ����ŷ�˵�GMP��¼1�У�û�й涨���ƻ��������ڡ�FDA ��������ָ����FDA����ҵָ��-��ҩƷ�����ӹ�-�������������淶������ 2004�꣩���������ڷ�Χ��ʹ����ҽҩ��Ʒ�е���;���Ĵ���-��һ�����Ƶ�ͼ�������а������ֿ��еĺͷǴ�����������Ϊ����ϵͳ��һ���ֵ�Ҫ�˷���ϵͳ�ڱ�2��������ע“b”�������ָ����ISO 5����Ũ�ȵ���100���ͽ��Ƶ���A.ŷ��Ȼ�����������ڱ��ĵ��У�ֻ������������������˵���������������ͬISO 5��100����A�����档“ƽ��”��仰���ڹ���������������ҵ�ĵ�������ʾ��ŷ�˵�GMPҪ��-����1����ŷ�ˣ�ҩƷ�̻��ܸ�ͼ��һ����EudraLex���������ҩƷŷ�����˵�4��ŷ��ָ�����룬�Զ�����Ͷ��������������淶ҽҩ��Ʒ�����ļ�����1��ҩƷ�IJ�Ʒ�������棩�IJ��䡣����1����������������/���������������ҩ���Ʒ��ע������1��5��״̬��“Ϊ���з����EN / ISO 14644-1�����涨����λ�õ���������С��Ŀ�ͻ�������������������Ƶ�������С�����ݵ����۷����ռ�“�����ĵ��������������Ⱦ�ȵı���������ݰ����ڱ�3�С��ڹ�ȥ�ļ�����Ѿ������ӵ�������ISO 14644-1���ڽ�ISO����ϵͳ��ǰ����ϵͳ���ı䡣Ȼ�������˾����ʹ�ô�ͳ��100������ʮ�ྻ�ҷ���ϵͳ���������209-E����ŷ�ޣ��̻��ܸ�ͼ�總��1ʹ����һ��ϵͳ���ȼ�A��Dָ��������ȫ������ҵѡ��ʹ���������ϵͳ��������Щϵͳ���ǿɽ��ܵ�Ӧ�á����ǣ�����Ҳ�����ڽ�ϵͳ���ӵ�һ�𣬱��磬ISO 10/100��/ A���������͵���������Ϊ����FDA��ָ����������2004�꣩�����Ҫ���������Ʒ����ʹ�ô����ӵķ���ϵͳҲ��̫������һ�����⡣���ǣ�����㲻�������ӹ���Ʒ��ѡ��ķ���ϵͳ������һ����ܻᵼ����������������209E������������������ļ���д�ġ����ļ��ķ�Χ������Ϊ��“ ���ļ��涨���࣬���ṩ�����ྻ��Ϊ����ָ�����������ӵ�Ũ�Ƚྻ�Һͽྻ��������ࡣ���涨�˺˲�����ྻ�ȵķ�����Ҫ�ƻ������������ྻ�ȡ������ṩ��һ�ַ�����ȷ��������������Ũ�ȣ�U��������“ͬ����Ҫ��������ļ���ȷ�������ƣ����а�����” ����ļ���Ҫ�ྻ�һ�ྻ�����������豸����Ʒ��ʹ�á����� ��С������˿ڣ����ļ�����ּ�ڱ�������������ѧ�����䣬������еĿ����Ŀ����ԡ�û��ͨ�õĹ�ϵ�Ѿ����������еĿ�����Ũ�ȵĺͿ��еĿ����еĿ�����Ũ��֮�䡣���� ��Ҫһ�����Ŀ�����Ӧ������������Ⱦ�ͷ��ϼȶ������ƣ��ر�Ҫ���DZ�Ҫ�����ڼ��Ϳ���������ʽ����Ⱦ��“������Щ���ƣ���Ҫ����������Ĵ�����������֧����Щ����ϵͳ��10/100��/��ʮ��ϵͳ���õķ��������Ҳ�����ᵽһ��“M”��ϵͳ���ࡣ����ļ����������ˣ�ͨ��ISO 14644-1ȡ����ISO 14644-1����ϵͳ ISO 14644-1���ྻ�Һ���ؿ��ƻ���-��1���֣������ྻ���ĵ���֤����ʽ������1999��䲼���ļ��涨�Ŀ����ྻ�ȷ������֤Ҫ���ļ��Ѿ�ȡ���˾ɵ������209-E��100������10��ָ�������ڱ��ļ��ĸ��ַ���ϵͳ�ǻ���������Ǵ����������ļ�����Ҫ���ļ������������Ʊ������ڱ�1�С�
��1��ѡ�������������ȵȼ��Ľྻ�Һͽྻ�����������ISO 14644-1�����ĵ����������������Ʒ�ľ���Ҫ��Ҳ�������κβ����������Ǵ������Ҫ����ˣ���FDA��������ָ����ŷ�˵�GMP��¼1�У�û�й涨���ƻ��������ڡ�FDA ��������ָ����FDA����ҵָ��-��ҩƷ�����ӹ�-�������������淶������ 2004�꣩���������ڷ�Χ��ʹ����ҽҩ��Ʒ�е���;���Ĵ���-��һ�����Ƶ�ͼ�������а������ֿ��еĺͷǴ�����������Ϊ����ϵͳ��һ���ֵ�Ҫ�˷���ϵͳ�ڱ�2��������ע“b”�������ָ����ISO 5����Ũ�ȵ���100���ͽ��Ƶ���A.ŷ��Ȼ�����������ڱ��ĵ��У�ֻ������������������˵���������������ͬISO 5��100����A�����档“ƽ��”��仰���ڹ���������������ҵ�ĵ�������ʾ��ŷ�˵�GMPҪ��-����1����ŷ�ˣ�ҩƷ�̻��ܸ�ͼ��һ����EudraLex���������ҩƷŷ�����˵�4��ŷ��ָ�����룬�Զ�����Ͷ��������������淶ҽҩ��Ʒ�����ļ�����1��ҩƷ�IJ�Ʒ�������棩�IJ��䡣����1����������������/���������������ҩ���Ʒ��ע������1��5��״̬��“Ϊ���з����EN / ISO 14644-1�����涨����λ�õ���������С��Ŀ�ͻ�������������������Ƶ�������С�����ݵ����۷����ռ�“�����ĵ��������������Ⱦ�ȵı���������ݰ����ڱ�3�С�